学習記録 1/13-1/19
勉強時間 49h
累計時間 661.5h
岡野の化学 118(途中から)~128
理論化学で重要な酸・塩基の学習に突入しました。
化学平衡と温度の関係、電離度と濃度の関係…
奥が深い。
電離度と濃度に関して調べていると、
水溶液の濃度が大きくなると電離度は小さくなる
こういう説明を見かけました。
“水溶液”はすなわち水が溶媒の溶液ですよね?
“溶液”というのは溶媒に溶液が溶解した液体状態
つまり、水溶液という用語は
単純に“水”を表すのではなく
“水+溶質”のことを示すのではないでしょうか。
水溶液の濃度が大きくなるというのは
水分子&溶質の分子の両者が増えた状態を示しますよね
そうすると、
水溶液の濃度が大きくなる=溶媒と溶質の濃度が大きくなる
すなわち、相対的に電離も進む
というイメージを持ちます。
しかし、実際には、濃度が大きくなると電離度は小さくなる
とされている。
自分の考えが一致しないため、更に調査をしていく。
電離度は濃度の影響を大きく受け、濃度があがるにつれて小さくなり、反対に無限に希釈した場合は 1 になる。
Wikipedia より
Wikiにも濃度との関係が書かれていましたが
“何の”濃度なのか記載はありませんでした。
次に”濃度”について調べると
従来、溶液中の溶質の割合を濃度という
Wikipedia より
と書かれていました。
これによると
濃度という用語自体が
溶質の割合を示すということがわかりました。
”水溶液の濃度が大きくなると電離度は小さくなる”
これでやっと理解出来ました。
溶質の濃度が大きくなると、
溶媒である水分子に対して、溶質の割合が大きくなり
電離度は小さくなりますね
更に、電離定数の式から考えれば理論的に理解が出来ます。
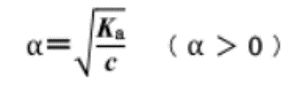
濃度cが小さくなれば、電離度αは大きくなることがわかります。